Titan là gì?
Titan còn được gọi là titani, là một nguyên tố kim loại phổ biến thứ 9 trong vỏ trái đất và là nguyên tố kim loại phong phú thứ 4, có ký hiệu là Ti và số thứ tự trong bảng tuần hoàn là 22.
“Titani hay titanium là một nguyên tố hóa học, một kim loại, có ký hiệu là Ti và số thứ tự trong bảng tuần hoàn là 22. titani là một kim loại chuyển tiếp có màu trắng bạc, tỉ trọng thấp và độ bền cao. Titani không bị ăn mòn trong nước biển, nước cường toan và chlor.” – Nguồn: https://vi.wikipedia.org/wiki/Titani
| Tên, ký hiệu | Ti |
| Số nguyên tử | 22 |
| Điểm nóng chảy | 1.668 °C |
| Khối lượng nguyên tử | 47,867 u |
| Số điện tử trên mỗi vỏ | 2, 8, 10, 2 |
| Độ âm điện | 1,54 |
| Tính chất từ | Thuận từ |
| Chuỗi hóa học | Kim loại, Kim loại chuyển tiếp, Nguyên tố chu kỳ 4, Nhóm nguyên tố 4 |

Titan là một kim loại màu xám sáng bóng, có tỷ lệ ăn mòn thấp và độ bền cao; nó được sử dụng cho các ứng dụng khác nhau.

Titan được phát hiện bởi William Gregor, một nhà hóa học người Anh, vào năm 1791; ông nghĩ đó là một hợp chất. Năm 1795, ông nhận ra nó là một yếu tố độc lập. Sau đó, Titan được đặt tên bởi Martin Heinrich Klaproth, một nhà hóa học người Đức, theo tên các Titan trong Thần thoại Hy Lạp.
Titan chiếm 0,44% vỏ trái đất và nó được phân bố rộng rãi. Chín mươi phần trăm (90%) titan xuất hiện ở dạng khoáng chất ilmenit trong vỏ trái đất. Khoáng chất Ilmenit là hợp chất của sắt, titan và oxy được gọi là oxit titan sắt với ký hiệu FeTiO3. Lượng titan còn lại được tìm thấy ở dạng anatase, perovskite, rutile, leucoxene, spine và các khoáng chất khác. Những khoáng chất này được tìm thấy dưới dạng các hợp chất trong cát, đá, đất và đất sét. Nó cũng có thể được tìm thấy ở những nơi khác trong tự nhiên: trong thực vật, nước tự nhiên, động vật, các ngôi sao và thiên thạch.
Kim loại titan được biết là có năm đồng vị bền. Chúng bao gồm titan-46, titan-47, titan-48, titan-49 và titan-50. Đồng vị phong phú nhất của kim loại titan là titan-48 với 73,8% phong phú tự nhiên, nhưng có rất nhiều đồng vị phóng xạ của titan.
Ngày nay, người ta đã biết 21 đồng vị phóng xạ của kim loại titan; ổn định nhất là titan-44, titan-45, titan-51 và titan-52. Tất cả bốn đồng vị phóng xạ ổn định có chu kỳ bán rã khác nhau. Chu kỳ bán rã của titan-44 là 63 năm, titan-45 có chu kỳ bán rã là 184,8 phút, titan-51 có chu kỳ bán rã là 5,76 phút và titan-52 có chu kỳ bán rã là 1,7 phút.

Tính chất của kim loại Titan
Tính chất vật lý
Kim loại titan được coi là có tính chất vật lý vượt trội. Nó được coi là một phần tử trơ về mặt sinh lý. Nó có tỷ lệ sức mạnh trên trọng lượng cao, làm cho nó trở thành một ứng cử viên lý tưởng trong các ứng dụng mà vật liệu nhẹ nhưng chắc chắn là cần thiết.
Ví dụ, thay thế khớp và cấy ghép nha khoa.
Titan là một kim loại rất mạnh có khối lượng riêng thấp 4,5 g / cm3 với nhiệt độ nóng chảy và sôi cao. Điểm nóng chảy của kim loại titan là hơn 1650 ˚C hoặc 3000 ˚F. Điểm sôi của titan là 3287 ˚C. Điểm nóng chảy và sôi cao làm cho titan trở thành một kim loại rất hữu ích về đặc tính chịu lửa. Titan cũng là một kim loại dễ uốn, đặc biệt là khi ở trong môi trường không có oxy. Vẻ ngoài bóng bẩy màu trắng xám của nó cũng rất hữu ích cho việc phủ kim loại hoặc để trưng bày.

Ngoài ra, titanium dioxide ở dạng tinh khiết thực tế rõ ràng, với chỉ số khúc xạ cao, tạo ra độ phân tán quang học cao – cao hơn kim cương. Titan có tính dẫn nhiệt và dẫn điện khá thấp khi so sánh với các kim loại khác mặc dù nó thể hiện tính chất siêu dẫn khi được làm lạnh dưới nhiệt độ 0,49 K, đây là nhiệt độ tới hạn của Titan. Khi titan ở dạng nguyên tố bị bắn phá bằng deuteron, nó có thể trở nên phóng xạ cao.
Titan nguyên chất gần như tinh khiết 99,2% và là một kim loại bóng, có mật độ thấp và khả năng chống ăn mòn cao. Titan thậm chí còn có khả năng chống lại các chất lỏng mạnh như axit sulfuric, khí clo ẩm, dung dịch clorua, axit clohydric và hầu hết các axit hữu cơ.
Tuy nhiên, Titan có thể cháy trong không khí và nổi bật là nguyên tố duy nhất có thể cháy khi có khí nitơ. Titan được coi là kim loại mạnh với độ bền kéo tối đa là 434 MPa, tạo ra 63.000 psi, gần bằng độ bền của hợp kim thép cấp thấp. Điều này có nghĩa là titan có thể được sử dụng thay thế cho thép – một lợi ích chính, vì nó nhẹ hơn thép 45%.
Titan bền gấp đôi nhôm và đặc hơn 60%. Đây là lý do tại sao hợp kim được sử dụng phổ biến nhất là hợp kim nhôm 6061-T6. Khi titan được trộn với các kim loại khác, các hợp kim có thể đạt độ bền kéo hơn 1.400 MPa, tạo ra 200.000 psi. Tuy nhiên, titan có thể mất độ bền ở nhiệt độ lớn hơn 430°C vì nó không cứng như thép cao cấp. Titan là một nguyên tố lưỡng hình có dạng lục giác, từ từ chuyển đổi thành một khối lập phương có tâm ở nhiệt độ cao 880˚C. Điều này xảy ra vì nhiệt lượng riêng bắt đầu tăng đột ngột khi đạt đến nhiệt độ chuyển tiếp 880˚C.

Tuy nhiên, khi nguyên tố ở dạng β lập phương, nhiệt dung riêng trở nên không đổi. Titan là một nguyên tố lưỡng hình có dạng lục giác, từ từ chuyển đổi thành một khối lập phương có tâm ở nhiệt độ cao 880˚C. Điều này xảy ra vì nhiệt lượng riêng bắt đầu tăng đột ngột khi đạt đến nhiệt độ chuyển tiếp 880˚C. Tuy nhiên, khi nguyên tố ở dạng β lập phương, nhiệt dung riêng trở nên không đổi. Titan là một nguyên tố lưỡng hình có dạng lục giác, từ từ chuyển đổi thành một khối lập phương có tâm ở nhiệt độ cao 880˚C. Điều này xảy ra vì nhiệt lượng riêng bắt đầu tăng đột ngột khi đạt đến nhiệt độ chuyển tiếp 880˚C. Tuy nhiên, khi nguyên tố ở dạng β lập phương, nhiệt dung riêng trở nên không đổi.
Tính chất hóa học
Tính chất hóa học của kim loại titan cho thấy những điểm tương đồng đáng kể với đặc tính của zirconi và silica. Titan, zirconi và silica đều thuộc nhóm chuyển tiếp đầu tiên trong bảng tuần hoàn. Titan nằm ở nhóm 4 (IVB) của bảng tuần hoàn, có nghĩa là nó nằm ở giữa. Sự sắp xếp của các nguyên tố trong biểu đồ tuần hoàn cho thấy các nguyên tố có liên quan với nhau như thế nào về mặt hóa học. Ở giữa bảng, chúng ta biết titan thể hiện các thuộc tính giữa kim loại và phi kim loại.
Ví dụ, cũng giống như magiê và nhôm, kim loại titan và các hợp kim của nó ngay lập tức bị oxy hóa bất cứ khi nào tiếp xúc với không khí. Titan nhanh chóng bắt đầu phản ứng với các phân tử oxy ở khoảng 1.200˚C, và nó có thể thể hiện hành vi tương tự ở nhiệt độ giảm xuống 610˚C khi oxy ở dạng tinh khiết. Mỗi phản ứng tạo ra titan dioxide.
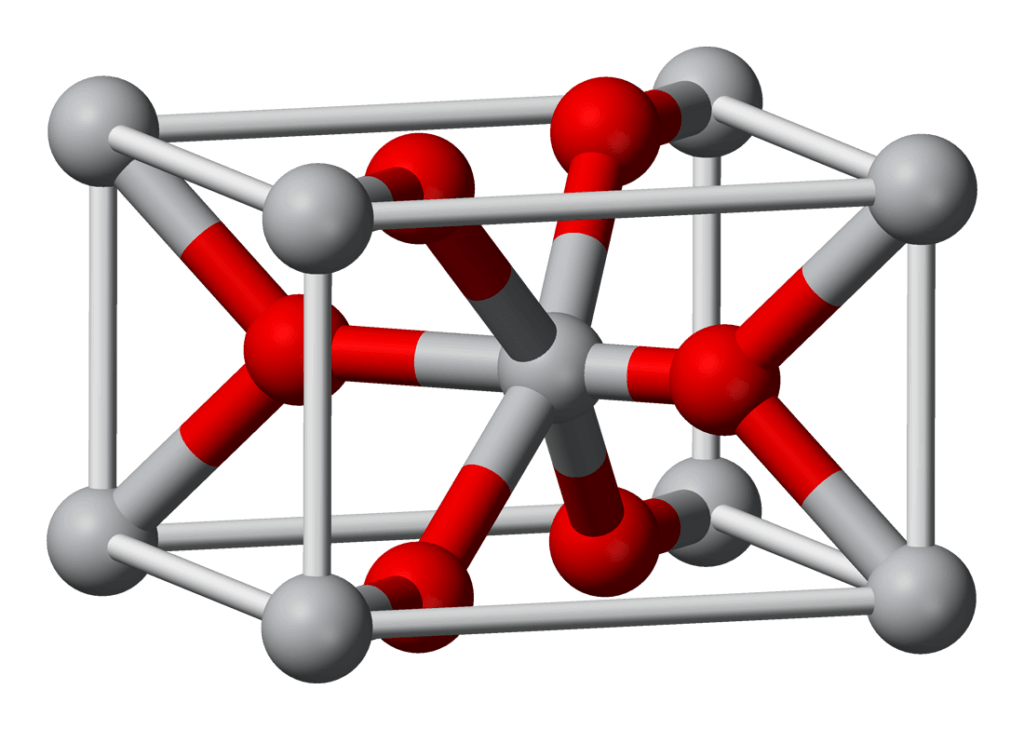
Titan hoạt động như một nguyên tố trơ khi có oxy và nước, có nghĩa là nó không phản ứng với oxy và nước ở điều kiện nhiệt độ xung quanh. Lý do cho hành vi như vậy là titan có xu hướng tạo ra một lớp phủ oxit thụ động, hoạt động như một chất bảo vệ để vật liệu bị oxy hóa thêm. Lớp bảo vệ này có thể mỏng đến 1 – 2 nm và dày tới 25 nm. Nó phụ thuộc vào khoảng thời gian khối kim loại tiếp xúc với oxy. Phải mất gần 4 năm để tạo ra một lớp dày 25nm. hoạt động như một chất bảo vệ để vật liệu không bị oxy hóa thêm. Lớp bảo vệ này có thể mỏng đến 1 – 2 nm và dày tới 25 nm. Nó phụ thuộc vào khoảng thời gian khối kim loại tiếp xúc với oxy. Phải mất gần 4 năm để tạo ra một lớp dày 25nm. hoạt động như một chất bảo vệ để vật liệu không bị oxy hóa thêm. Lớp bảo vệ này có thể mỏng đến 1 – 2 nm và dày tới 25 nm. Nó phụ thuộc vào khoảng thời gian khối kim loại tiếp xúc với oxy. Phải mất gần 4 năm để tạo ra một lớp dày 25nm.
Lớp bảo vệ này cho phép titan trở thành nguyên tố chống ăn mòn tuyệt vời – hiệu quả gần như bạch kim. Đặc tính này làm cho nó có khả năng chống lại các chất lỏng mạnh như axit sulfuric, khí clo ẩm, dung dịch clorua, axit clohydric và hầu hết các axit hữu cơ. Tuy nhiên, nó có thể bị ăn mòn khi tiếp xúc với axit đậm đặc. Về mặt nhiệt động lực học, titan là một kim loại rất dễ phản ứng do khả năng oxy hóa khử âm của nó, và nó cháy trong khí quyển ở nhiệt độ thấp hơn nhiệt độ nóng chảy của nó. Nó có thể phản ứng với clo ở 550 ˚C và cũng có thể kết hợp với các khí halogen khác mặc dù nó hấp thụ hydro. Sự nóng chảy của titan chỉ có thể xảy ra trong môi trường trơ về mặt hóa học như chân không. Đặc tính nhiệt động học của Titan không cho phép nó nóng chảy trong điều kiện bình thường, bởi vì nó trở nên phản ứng mạnh hơn ở nhiệt độ cao và có thể bốc cháy nếu các phân tử oxy có trong môi trường của nó. Tuy nhiên, như đã đề cập trước đây, titan nói chung là không hoạt động.
Titan là một kim loại chuyển tiếp cũng thể hiện những điểm tương đồng về tính chất hóa học của nó, đặc biệt là ở các trạng thái ôxy hóa thấp hơn, với crôm và vanadi. Nó có các trạng thái oxy hóa khác nhau, bao gồm 4+, 3+ và 2+. Tuy nhiên, trạng thái oxy hóa 4+ là ổn định nhất. Quặng titan oxit khử bằng hơi nước và tạo thành dioxit và hydro. Nó phản ứng theo cách tương tự với axit đặc nóng — với một sự khác biệt nhỏ. Khi phản ứng với axit đặc nóng, nó tạo ra axit clohydric và triclorua.

Hợp chất và tính chất kim loại titan
Tính chất hóa học titan bị chi phối bởi trạng thái oxy hóa titan +4 vì đây là trạng thái ổn định nhất mà titan xảy ra. Tuy nhiên, trạng thái oxy hóa + 3 của các hợp chất titan cũng rất phổ biến. Đương nhiên, phức chất titan có dạng hình học phối trí bát diện, nhưng một ngoại lệ đáng chú ý ở đây là TiCl4. Hợp chất này được gọi là titan tetraclorua, và nó có dạng hình học tứ diện. Hình dạng này là do trạng thái oxy hóa cao của titan tetraclorua, dẫn đến mức độ liên kết cộng hóa trị cao hơn. Chỉ trong kim loại chuyển tiếp, titan được biết là tạo thành phức chất aqua Ti (IV): phức chất ion titan phối tử nước.
Oxit, Sunfua và Alkoxit
Thuật ngữ titanat chỉ các hợp chất titan (IV): các hợp chất (nguyên tố) titan, chẳng hạn như TiCl4, titan tetraclorua và BaTiO3, bari titanat. Các hợp chất này được biết đến với đặc tính áp điện và phục vụ tốt trong việc chuyển đổi giữa âm thanh và điện như các bộ chuyển đổi. Khoáng chất mà titan được tìm thấy nhiều nhất, ilmenit, cũng là một titanat. Ilmenite là một hợp chất FeTiO3. Các ngôi sao, hồng ngọc và ngọc bích cũng có các đặc tính TiO2 titan điôxít của một tiểu hành tinh. Đây là lý do họ có sự tỏa sáng hình sao. Oxit quan trọng nhất của tất cả các oxit titan là TiO2; titanium dioxide xuất hiện ở ba trạng thái đa định hình khác nhau: rutile, anatase và brookite. Cả ba trạng thái đa hình đều là chất rắn có từ tính màu trắng.
Ngày nay có rất nhiều titan suboxit được biết đến. Phép đo phân cực giảm của titanium dioxide đạt được bằng cách phun plasma trong khí quyển. Titan (III, IV) oxit, Ti3O5 là chất bán dẫn màu tím thu được từ quá trình khử Titan đioxit TiO2 trong điều kiện có khí hydro ở nhiệt độ cao. Oxit titan (III, IV) là một hợp chất lý tưởng để phủ hơi bề mặt bằng oxit titan để chống ăn mòn và mục đích thẩm mỹ.
Các alkoxit của titan thu được bằng cách cho titan tetraclorua phản ứng với rượu. Những chất này được sử dụng lý tưởng để lắng đọng titan dioxit rắn với sự trợ giúp của quá trình sol-gel trong các ngành công nghiệp. Ngoài ra, titan iso-prop-oxide được sử dụng để điều chế các hợp chất hữu cơ bất đối với sự trợ giúp của quá trình Sharpless epoxidation. Titan cũng có nhiều loại hợp chất sulfit. Tuy nhiên, titan disulfua là titan sulfua duy nhất được sử dụng thường xuyên. Nó có cấu trúc phân lớp và đóng vai trò như một cực âm trong sản xuất pin lithium-ion.

Nitrua và cacbua
Titan nitrua và cacbua là thành viên của họ chuyển tiếp chịu lửa. Các nitrua của titan có tính chất của cả hai hợp chất cộng hóa trị. Chúng thể hiện độ cứng cực cao, nhiệt độ nóng chảy và điểm sôi cao, ổn định nhiệt động lực học và độ dẫn nhiệt và điện cao. Titan nitrua, TiN, có độ cứng 9,0 trên thang Mohs, có độ cứng tương đương với sapphire và carborundum.
Do tính chất cực cứng này, nó được sử dụng làm vật liệu phủ cho các dụng cụ cắt; ví dụ, các mũi khoan được phủ titan nitrua và cacbua. Nó cũng được sử dụng để phủ cho các mục đích thẩm mỹ vì nó tạo ra một lớp hoàn thiện màu vàng sáng bóng. Nó cũng đóng vai trò như một vật liệu rào cản trong việc chế tạo chất bán dẫn.
Halide
Halogenua phổ biến nhất của titan là titan tetraclorua, TiCl4, là một chất lỏng không màu và dễ bay hơi. Titan tetraclorua công nghiệp có màu hơi vàng và có xu hướng thủy phân trong không khí với sự phát xạ ngoạn mục của những đám mây màu trắng. Titan tetraclorua cũng được sử dụng trong quá trình khai thác kim loại titan từ quặng của nó. Quá trình này được gọi là quá trình Kroll.
Ngoài ra, nó phục vụ để thu được titanium dioxide, được sử dụng trong sơn màu trắng. Các halogenua titan được sử dụng rộng rãi như một axit Lewis. Titan tetraiodide, TiI4, một halogenua khác của titan, thu được từ quy trình Van Arkel là kim loại titan có độ tinh khiết cao. Titan (III) và titan (II) cũng có thể tạo thành các halogenua ổn định. Một ví dụ quan trọng là titan triclorua và titan diclorua. Những hợp chất này được sử dụng làm chất xúc tác trong sản xuất polyolefin.
Hợp chất cơ kim
Hợp chất cơ kim phổ biến nhất được biết đến của titan là titanocene-dichloride, (C5H5) 2TiCl2. Các phức chất cơ kim loại titan được nghiên cứu chuyên sâu để làm xúc tác trùng hợp. Các phức chất cơ kim khác của titan bao gồm thuốc thử Petasis và thuốc.
Quy trình chế tạo kim loại Titan
Quá trình sản xuất kim loại titan được thực hiện bằng quy trình gọi là quy trình Kroll. Quá trình này có năm giai đoạn. Giai đoạn đầu tiên được gọi là chiết xuất, giai đoạn thứ hai được gọi là tinh chế, thứ ba được gọi là sản xuất bọt biển, giai đoạn thứ tư liên quan đến việc tạo hợp kim và cuối cùng, bước thứ năm là tạo hình và định hình. Vì mọi bước đều tốn thời gian và chi phí nên chưa có ngành nào thực hiện cả 5 bước. Hầu hết các ngành công nghiệp thực hiện một giai đoạn duy nhất của quá trình này. Ví dụ, một số nhà sản xuất chuyên sản xuất bọt biển và những nhà sản xuất khác chỉ tạo ra các hợp kim.

Khai thác
Bước đầu tiên của quy trình Kroll là khai thác quặng titan. Nhà sản xuất nhận quặng titan từ các mỏ. Những loại quặng này có thể ở dạng ilmenit, rutil hoặc bất kỳ khoáng chất nào khác của titan. Rutile thường được sử dụng ở dạng tự nhiên. Tuy nhiên, ilmenite cần quá trình xử lý trở thành bước đầu tiên để loại bỏ sắt để phần còn lại có 85% hoặc titanium dioxide. Đối với quá trình này, những quặng này được đặt bên trong lò phản ứng tầng sôi với clo và cacbon và được nung đến nhiệt độ cao hơn 900 ° C. Phản ứng hóa học xảy ra, dẫn đến việc tạo ra titan tetraclorua ở dạng không tinh khiết và carbon monoxide như một sản phẩm phụ. Các tạp chất có trong TiCl4 vì sau khi loại bỏ sắt, titan đioxit vẫn chưa tinh khiết.
Thanh lọc
Trong bước này, TiCl4 được đưa vào bên trong một bình chưng cất lớn để đun nóng. Các tạp chất có trong bước này được tách ra bằng phương pháp chưng cất và kết tủa phân đoạn. Hai phương pháp này loại bỏ tất cả các tạp chất, bao gồm vanadi, silicon, magiê, zirconium và sắt.
Sự hình thành bọt biển
Giai đoạn thứ ba của quá trình Kroll là hình thành bọt biển. Trong giai đoạn này, titan tetraclorua tinh khiết được đưa vào bình phản ứng bằng thép không gỉ ở dạng lỏng. Sau khi chuyển giao, magie được thêm vào bình và nung hỗn hợp này đến nhiệt độ 1100 ° C để magie phản ứng với clo và tạo ra magie clorua. Có khả năng oxy và nitơ có thể có trong không khí, vì vậy khí argon được bơm vào bình để loại bỏ không khí nhằm tránh bất kỳ phản ứng nào với oxy và nitơ. Titan còn lại trong bình không tinh khiết và ở dạng rắn vì nhiệt độ nóng chảy của titan cao hơn nhiều. Chất rắn titan này hiện được lấy ra khỏi bình bằng quy trình doa và được xử lý bằng hỗn hợp nước và axit clohydric. Điều này là để loại bỏ bất kỳ dư thừa magiê và magiê clorua.
Hình thành và Định hình
Trong giai đoạn cuối của quy trình Kroll, các thỏi được đưa ra khỏi lò, kiểm tra các khuyết tật, sau đó được gửi đi để sử dụng để tạo ra các sản phẩm hợp kim titan. Các thuộc tính của mỗi thỏi được kiểm tra để đảm bảo chúng đáp ứng các yêu cầu của khách hàng. Các thỏi này trải qua các quá trình khác nhau như hàn, tạo hình, đúc, rèn, luyện kim bột, v.v. để được tạo hình thành hoàn thiện tốt. Tất cả phụ thuộc vào đặc điểm kỹ thuật của sản phẩm được yêu cầu.
Sản phẩm phụ của Quy trình Kroll
Trong quá trình Kroll, khi titan được tách ra khỏi các tạp chất, một lượng đáng kể magie và magie clorua sẽ bị bỏ lại. Sản phẩm phụ này của quy trình Kroll được tái chế ngay lập tức trong một ô tái chế. Tế bào tái chế phân tách magiê và clo thành các dạng ổn định của chúng. Tức là magie ở thể rắn và clo ở thể khí. Khí clo được thu thập từ phía trên cùng của ngăn tái chế và cả hai thành phần này được sử dụng lại trong quy trình Kroll.
Ứng dụng của Titan trong đời sống
Ngành y tế
Titan đóng một vai trò quan trọng trong ngành y tế vì tính tương thích sinh học của nó. Nó là một vật liệu không độc hại đã được sử dụng trong nhiều công cụ phẫu thuật và cấy ghép. Từ thay thế ổ cắm bi hông đến cấy ghép nha khoa, titan đã được sử dụng trong ngành y tế với nhiều mục đích khác nhau. Những bộ phận cấy ghép này có thể tồn tại trong hơn 20 năm. Các bộ phận cấy ghép bằng titan thường chứa khoảng 4% vanadi và 4% đến 6% nhôm.
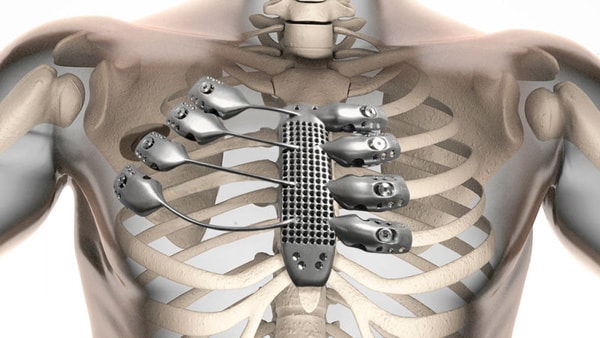
Titan có khả năng tích hợp Osseo, cho phép chúng ta sử dụng nó trong cấy ghép nha khoa và cấy ghép chỉnh hình có thể tồn tại trong 30 năm. Do độ đàn hồi mô-đun thấp hơn, cấy ghép titan cho phép tải trọng xương được phân bổ đều giữa xương và mô cấy, dẫn đến giảm thoái hóa xương do căng thẳng và gãy xương chu kỳ. Titan có độ cứng lớn hơn xương người, có thể dẫn đến thoái hóa xương trong trường hợp tải trọng tăng lên.
Sắc tố và phụ gia
Titan chủ yếu được tinh chế thành titan điôxít, là một chất màu trắng vĩnh viễn. Chất màu trắng này được sử dụng trong giấy, kem đánh răng, nhựa và sơn. Sơn với titanium dioxide hoạt động tốt hơn trong nhiệt độ khắc nghiệt và môi trường ẩm ướt. Nó cũng phục vụ mục đích của nó trong xi măng, độ mờ quang học trong giấy và đá quý. Điều này cũng được thêm vào thanh hoàn thiện bằng composite graphite và gậy đánh gôn để tăng sức mạnh của chúng. Titanium dioxide là một hợp chất trơ về mặt hóa học, có khả năng chống ăn mòn và không bị phai dưới ánh sáng mặt trời. Nó cũng có vẻ ngoài rất mờ, nên thích hợp để sử dụng làm chất màu trong sản xuất phần lớn đồ nhựa gia dụng. Ngoài các công dụng đáng kể như một chất màu, titanium dioxide còn được sử dụng trong kem chống nắng do chỉ số khúc xạ và phân tán quang học cao.
Ngành công nghiệp hàng không vũ trụ
Titan có khả năng chống ăn mòn cao, chống mỏi cao, độ bền kéo cao trên tỷ trọng, khả năng chống nứt cao và khả năng chịu nhiệt độ cao. Nó được coi là vật liệu lý tưởng để chế tạo máy bay, tên lửa, mạ áo giáp. Nó được sử dụng trong sản xuất các bộ phận cấu trúc quan trọng, thiết bị hạ cánh, ống xả, tường lửa và hệ thống thủy lực. Trên thực tế, titan chiếm gần 50% vật liệu được sử dụng trong máy bay. Hợp kim titan được sử dụng bao gồm nhôm, niken zirconium, vanadi và các nguyên tố khác.

Trang sức
Titan bền và trơ về mặt sinh học, điều này đã làm tăng tính phổ biến của nó trong ngành trang sức. Tính trơ của nó khiến nó trở thành lựa chọn phổ biến của những người bị dị ứng và những người sống trong môi trường ẩm ướt. Độ bền, khả năng chống móp méo, trọng lượng nhẹ và chống ăn mòn khiến nó trở nên hữu ích trong việc sản xuất đồng hồ đeo tay và hộp đựng đồng hồ. Một số nghệ sĩ sử dụng titan để chế tạo các tác phẩm điêu khắc và các đồ vật trang trí khác. Titan cũng được trộn với vàng để tạo ra hợp kim vàng 24 karat, kết quả là hợp kim này cứng hơn vàng 24 karat nguyên chất. Titan Anodized có các tua giao thoa quang học và nhiều màu sắc tươi sáng, khiến nó cũng trở nên phổ biến cho các loại khuyên trên cơ thể.


Trong quá trình chế tác, titan có thể được khoác lên mình nhiều màu sắc đa dạng, điều này đã mang lại cho người mua nhiều sự lựa chọn không chỉ về kiểu dáng mà còn về cả màu sắc.
Công nghiệp hàng hải
Titan là vật liệu chống ăn mòn; điều này làm cho nó trở nên lý tưởng để sử dụng trong ngành công nghiệp hàng hải. Vỏ tàu hải quân được làm bằng hợp kim titan vì khả năng chống ăn mòn của chúng đối với nước biển. Titan cũng được sử dụng để sản xuất trục chân vịt, trao đổi nhiệt, giàn, thiết bị làm lạnh nhiệt cho bể cá nước mặn, dao và dây chuyền hoàn thiện của người lái và các đầu dẫn. Ngoài ra, nó được sử dụng trong các thiết bị giám sát và thiết bị giám sát được triển khai trong nhà ở và đại dương.

Công nghiệp ô tô
Titan được sử dụng trong ngành công nghiệp ô tô, đặc biệt là những nơi yêu cầu trọng lượng thấp và độ cứng cường độ cao. Nó cũng hiệu quả về mặt chi phí vì kim loại thường quá đắt để được sử dụng với số lượng lớn. Nó được sử dụng để sản xuất van xả và van nạp bên trong động cơ vì khả năng chịu nhiệt và độ bền cao.



Ảnh hưởng đến sức khỏe và môi trường của kim loại Titan
Titan có áp lực lớn với oxy và các nguyên tố khác, vì vậy không thể tìm thấy titan ở trạng thái kim loại trong tự nhiên. Nồng độ titan trong không khí của các khu vực đô thị là dưới 0,1 µg / m3 Tuy nhiên, ở một số khu vực, đặc biệt là những nơi gần các nhà máy, 1,0 µg / m3 cũng đã được báo cáo. Nồng độ này ảnh hưởng đến nguồn cung cấp nước uống và các mặt hàng thực phẩm. Do đó, lượng titan của con người đã được báo cáo từ 300 µg / ngày đến 2 mg / ngày.
Các nghiên cứu lâm sàng trên động vật và con người đã chỉ ra rằng nếu hít phải titanium dioxide, nó vẫn trơ về mặt sinh học. Khả năng bị xơ hóa yếu do tiếp xúc với bụi titan có nhiều khả năng do tiếp xúc đồng thời với các thành phần khác có trong bụi titan hơn là điôxít titan. Tuy nhiên, ở động vật, nitrit titan, titan hydrua và cacbua titan có thể gây ra các hiệu ứng tạo sợi. Những hợp chất này của titan cũng có thể gây ra chứng loạn dưỡng thận và gan ở động vật. Tuy nhiên, titan tetraclorua có tác dụng khác đối với cả người và động vật. Ở người, hợp chất này có thể gây bỏng da và kích ứng mạnh ở mắt. Ngoài ra, titan ở dạng bột được biết là gây ra bạch cầu và fibrosarcoma, nhưng chỉ ở chuột khi chúng được tiêm. Không có bằng chứng cho thấy nó có bất kỳ tác dụng gây ung thư nào ở người. Ngoài ra, titan thường được sử dụng trong các nghiên cứu về độ thanh thải của phổi. Các nghiên cứu đã không cho thấy bất kỳ tác động bất lợi nào của titanium dioxide đối với phổi.
Titan có vai trò chủ đạo trong ngành công nghiệp cấy ghép và phục hình. Các nghiên cứu trên động vật và con người đã chỉ ra rằng sự hiện diện của titan trong cấy ghép và bộ phận giả không ảnh hưởng đến các mô của con người. Chất lỏng và mô mềm có trong cơ thể động vật và con người có khả năng chịu titan cực cao. Điều này có nghĩa là không có báo cáo về kích ứng hoặc chậm lành vết thương và có sự bao bọc của kim loại bởi các mô xơ. Các hợp chất titan như dioxit, oxit, tannatri và salicylat đóng một vai trò quan trọng trong các công thức da liễu và mỹ phẩm. Chúng không cho thấy bất kỳ tác dụng phụ nào đối với làn da của con người. Tuy nhiên, việc tiếp xúc với các hợp chất titan khác nhau có liên quan đến chứng xơ phổi nhẹ.
Kết luận
- Titan là một kim loại màu xám sáng bóng, có tỷ lệ ăn mòn thấp và độ bền cao.
- Nó là một kim loại rất hữu ích cho các đặc tính chịu lửa do nhiệt độ nóng chảy và nhiệt độ sôi cao.
- Các hợp chất kim loại titan bao gồm oxit, sunfua, alkoxit, nitrit, cacbua, v.v…
- Kim loại titan được chế tạo bằng phương pháp gọi là ‘phương pháp Kroll’.
- Các ngành công nghiệp khác nhau, bao gồm y tế, hàng không vũ trụ và ô tô, sử dụng kim loại titan và các hợp kim của nó do độ bền cao của nó.
- Một số hợp chất titan có thể có tác động xấu đến sức khỏe và môi trường.
Mạ PVD inox Đa Hình đã giúp bạn giải đáp được những câu hỏi như Titan là gì? Có những tính chất đặc trưng nào, ứng dụng ra sao? Nếu bạn cần gia công mạ pvd (mạ titan pvd) vui lòng liên hệ ngay để được tư vấn và báo giá tốt nhất.
Nguồn: https://www.iqsdirectory.com/articles/titanium/titanium-metal.html



